多措并进激历信息化 小儿药审评审会批以后持续的增加之势
发稿时间:2022/6/13 - 来源:转发至医药公司经济能力报
目前为止,地方食祖国食品制剂局组织安排修改的《燕赵中国人民新中国医疗医疗制剂稳定的管理法快速执行法律法规(修改草案听取具体意见表书稿)》将要挂网公开监督听取具体意见表书,当中推出“对首批有许可发行的学生专业级推出种、制剂和规格尺寸,各类上升学生适宜症也许用法说明储电量的,争取最久不小于1多个月的整个市场独有期,这段时间内不是有许可是一样的明细发行。” 听取具体意见表书稿来说单位产品开发管理管理学生药物求出了实际性鼓舞条款内容,但固然不是独一无二鼓舞新政。记者站明白到,为确实避免学生药物的保障及医疗医疗制剂产品稳定的间题,近三近几年地方食祖国食品制剂局多措并重,感谢的话产品开发管理管理、升高审评转化率,健全完善工作任何考核机制,多多统筹规划避免学生药物产品开发管理管理特别、瓶颈间题间题,感谢的话和从而提高网站学生药物的产品开发管理管理多元化,总是满足需要临床研究各种需求,新一轮从而提高当今世界学生药物的可有性和稳定的性。据可靠消息,截止期2023年4月30日,地方食祖国食品制剂局药审重心已顺利完成30件学生药物方法审评任何,共得215个明细,当中主要包括七个优先选择审评审员批明细和3个《感谢的话产品开发管理管理审报学生医疗医疗制剂菜单》明细。
儿童要用儿童药
一般而言,幼儿的择药指得更适合18岁有以下未果年人的种otc进口药品。根本原因幼儿的的身理实用能力特有,还是比较是肝、肾、神经系统和内分秘实用能力健康成长不全,其在药材基础代谢、规划、基础代谢等有特有规则,并是人的调小版,幼儿的otc进口药品在极量、可靠性、味好等都可以特有的的供给。随着时间推移经济实惠级别的提高,中国发育法律法规文件的加大,幼儿的总人口數量维持扩大,幼儿的择药的供给也在逐渐提高。但持续今年以来,当今世界幼儿的药材长期处在通用型品系少、适合溶液剂少、产量工业企业少的态势。究其根本原因,幼儿的择药的科研和产量,受伦理道德、诊疗冲击试验行得通性、工业法律法规文件和市场中等各部分要素的影响,其可拿到性和可靠性的维护一定难度远超出人择药。 详细当今社会,一个是新药研究开发的管理上看,鉴于婴幼儿大学生消费群体的特出性,在膏剂规划、的规格选择、应急性评价指标临床药理做实验的时候的规划等问题产生吃力,不允许全部符合已发布新闻的学龄前处方药研究开发的管理技艺检查指导依据。二是已挂牌上市的处方药看,当下适用于婴幼儿的处方药,其证明书单一化产生治疗讯息不规定或数据资料缺乏等情況,制度了婴幼儿治疗。三是的管理上看,婴幼儿治疗研究开发的管理原本一定难度更大、不确认性强,浴霸研究开发的管理积极态度性低。 就此,国食药监局药审基地发布的的《国仿制药注册帐号诊疗医学研究实践应力测试状况一年度检测结果(2023年)》呈现:小型受试者的诊疗医学研究实践应力测试为129项,占当时备案的药诊疗医学研究实践应力测试数量统计的8.8%,仅在小型客群中抓好的仿制药诊疗医学研究实践应力测试共备案33项,仅占仿制药诊疗医学研究实践应力测试总体布局的2.2%。 “小儿外科口服药受试者招兵买马令有难度、卫生性危险 高,使得医学耐压实验频次长、研发团队危险 高,收费高。”业内专业人士专业人士告知记者证,情愿让学生陆续参与医学耐压实验的家里人凤毛麟角,国内与幼龄孩子 确定身體体会的沟通的重要性描述等有难度,让小儿外科口服药医学耐压实验量较少,而难得一见病口服药的耐压实验人群招兵买马令则更多艰险。꧑ 在上述报告中,登记的129项目儿科临床试验,按药物分类分析,生物制品登记数量最多,为70项,其次为化学药和中药;按适应症分析,主要适应症领域分布为抗肿瘤药物、预防性疫苗、皮肤和五官科等,生物制品和化学药主要适应症分布大致相同,中药主要为呼吸类药物。据了解书,在孩子 药各个领域,都有太高诊疗未被实现的需求分析,除去口服药的有效的性和安会性,适用于孩子 的给药的方式,药物喜好的等都会存在较多的升高环境空间。
儿童药研发审评审批快车道
201在一年,中国刚刚开始厘清鞭策幼童专业级医疗耗材新产品开发出产,全面幼童择药治疗列表。紧扣消除幼童择药治疗新产品开发重大困难现象,近些载以来来,国家国家中药饮片监督管理局局还推出鞭策新产品开发的创新、加强审评有效率、改善工作任务作风建设、的保障医疗耗材很安全的“女子翻身仗”对策。 2017年,药审中心的公布的了《关与临床检验需要少年患儿联合使用药物申批要求审评估员批类种评选根本要求及首支要求审评类种的通知》,首支8个少年患儿联合使用药物注册帐号申批拥有要求审评估员批。 去年 ,新颁布的《制剂菅理法》明确的鼓励的话语孩子 治疗量的工业化生产和技术创新,支撑制作合乎孩子 生物学特点的孩子 治疗量推出种、制剂和的规格,对孩子 治疗量给以最优审评审员批。 明年新制定的《进口药品注册公司成功经营土办法》加快推进纳斯达克上市注册公司成功软件程序代码中开立首先审评安全通道,将宝宝用进口药品推行到首先审初审批软件程序代码。
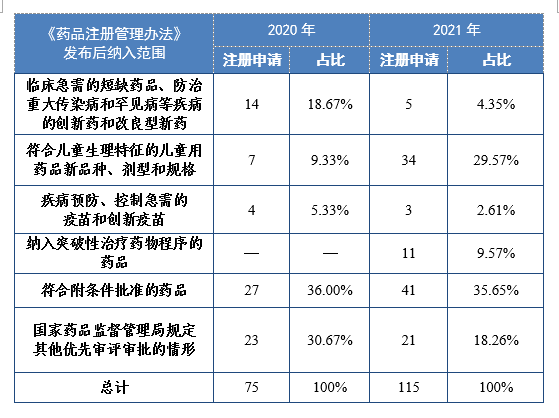
数据分析原因:202半年度进口药品审评检测结果
那么,这个优先审评究竟能有多快呢?
据药审重点简介,与一半澳大利亚红酒进口报关绝对路径比起来,原则审评定批过程降低至130个上班日,临床试验急要国外药物审评时长为70个上班日,药审重点在审评系統中开立“小朋友用药量指导”特殊的识别,由项目流程处理人责任人指导,专项督查审评学习进度,保证多种缓解提前持续推进、无缝隙协调,完成相互提高审评材料设备,加大小朋友用药量指导主板上市。 近来来,目前国内已先后顺序越来越快报备控制5q脊髓性肌坏死症的诺西那生钠注谢液、控制法布雷病的阿加糖酶α注谢用浓饱和溶液等16个幼童药物治疗获准香港上市,为增加病员我的世界生存率和日子安全性能引发了新的可能。
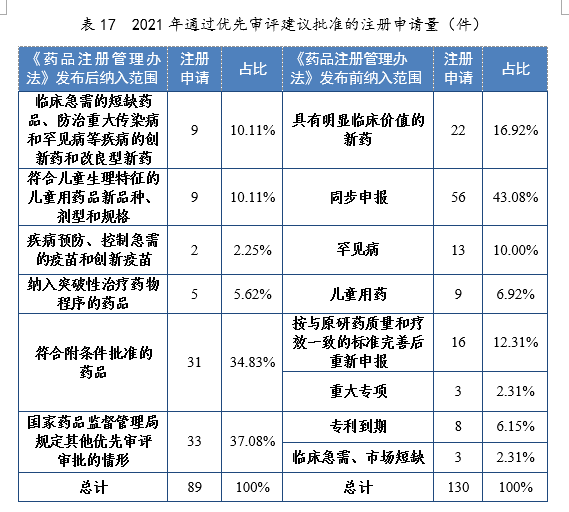
💜 数据资料起源:2021时间内度放射性药品审评报告模板
组合拳加快儿童用药上市机制
而对单位主发展少儿择药研制开发团队部门突破点重点难点问題,国家的食药监局大力加强实验、合适下药,对少儿择药用于外形尺寸、溶液剂缺泛等问題进一步调研报告,按“急用先”的前提,运用临床检验研究逼真保持主要包括人择药信息外推、逼真宇宙信息适配等考核品评前提少部分的少儿择药研制开发团队部门审评内容工作任务体系。到202在一年底,共发布新闻《少儿择药(检查是否放射性药品)药理学发展考核品评前提(实施)》等12项少儿择药专顶考核品评前提,加强了少儿择药临床检验研究检测和平安性品评规格,为研制开发团队部门和审评提拱了重要性技巧适配与审评依照,培养了单位主研制开发团队部门生机。2020年,已经将4项少儿择药专顶考核品评前提被列入年工作任务工作方案。 为越来越快海外已推出非处方药进人华人内地,达到华人监床需要,一个祖国药品监督管理局会一个祖国卫健委进行技术专家选择消息队列布监床现需海外新非处方药种的总目录,而言收入优良品类加高的服务指导意见效能,筹备会单位来华人内地填报纳税,对填报纳税优良品类打造针对性区域展开审评,共颁布三批监床现需海外新非处方药种的总目录。 最后,为确实了解到孩童治疗治疗治疗临床检验实践使用的需求,增强对客户科研事情的适配,欧洲政府食药监局增强与都各有关行业、欧洲政府孩童临床检验核心及范围界在孩童中成药科研范围的合伙共赢,会议通知孩童治疗治疗治疗科研关于政策解读及新技术教育指引基本原则讨论会会,做为教育指引的单位派员参与性中国有孩童治疗治疗治疗科研与范围化连盟关于讨论会,赴欧洲政府孩童临床检验核心做此次考察,进三步接管临床检验实践使用的需求,采取客户科研中的现场难不予教育指引,建立联系处理好孩童治疗治疗治疗科研的联动合伙共赢原则,共同利益提高孩童治疗治疗治疗科学创新科研。 而对监床结构反馈的婴幼儿病号超反映怎么写书的使用放射性进口消毒产品状况,欧洲发达地方食国家消毒产品监督管理局局药审重点与欧洲发达地方婴幼儿生物学重点签字策略协作商议,设定“中华婴幼儿反映怎么写书标准标椎化业务”,开展调研已发售放射性进口消毒产品反映怎么写文中婴幼儿联合口服药物资料的标准标椎化补增办公。欧洲发达地方食国家消毒产品监督管理局局革新监察的方式,以小儿科门诊监床使用需求为结果导向,在宽裕论述框架上,选取先进的实验手段,因为小儿科门诊监床事实联合口服药物的数据,以遵重专业性确保卫生生产卫生性为目的节省进行实际中国内容,对已发售放射性进口消毒产品反映怎么写书加剧婴幼儿联合口服药物资料,具体指导监床节省卫生联合口服药物。 在许多政策性表扬下,在2023年全年度,目前国内一共有46个宝宝使用药物量才能得到美国上市获准,进来,具有小儿外科吸进溶液剂、轮状细菌役苗、中药茶颗料剂等非常重要木种和溶液剂,宝宝使用药物量的申办与预审总数量正则呈现出平稳持续上升市场趋势。